将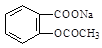 转变为
转变为 的方法为:
的方法为:
| A.与足量的NaOH溶液共热后,再通入CO2 | B.溶液加热,通入足量的HCl |
| C.与稀H2SO4共热后,加入足量的Na2CO3 | D.与稀H2SO4共热后,加入足量的NaOH |
25 ℃ 时,下列各溶液中关系的叙述中,正确的是()
| A.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-) =" 0.1" mol/L,则BA(盐)溶液pH<7 |
| B.pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2∶1 |
| C.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na+) + c(H+)=c(OH-) + c(CH3COO-) |
| D.4种pH相同的溶液①CH3COONa ②NaClO ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol•L‾1的一元酸HA与b mol•L‾1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是()
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)=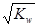 mol•L‾1 mol•L‾1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH‾)+c(A‾) |
根据右表提供的数据,判断在等浓度的 、
、 混合溶液中,各种离子浓度关系正确的是()
混合溶液中,各种离子浓度关系正确的是()
A.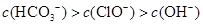 |
B. |
C.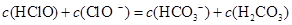 |
D.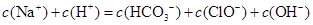 |
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3-)都减少,其方法是()
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.通入氯化氢气体 | D.加入饱和石灰水溶液 |
室温时,某溶液中由水电离生成的H+和OH-物质的量浓度的乘积为10-24,则在该溶液中一定不能大量共存的离子组是()
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、CO32- |
| C.K+、Na+、Cl-、SO42- | D.NH4+、K+、SiO32-、NO3- |