下列化合物中,既显酸性,又能发生加成反应、氧化反应、酯化反应和消去反应的是
A. |
| B.CH2(CHO)-CH2-CH(OH)-COOH |
| C.CH3—CH=CH—COOH |
| D.CH3CH(OH)CH2CHO |
焰色反应每次实验都要先用某一试剂洗净铂丝,这种试剂是
| A.Na2CO3溶液 | B.NaOH溶液 | C.稀盐酸 | D.稀硫酸 |
等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中
| A.Na2CO3放出的CO2多 | B.NaHCO3放出的CO2多 |
| C.Na2CO3放出CO2的速度快 | D.NaHCO3放出CO2的速度快 |
下列区分Fe(OH)3悬浊液和Fe(OH)3胶体的方法中,正确的是
| A.静置片刻出现分层现象的是Fe(OH)3胶体 |
| B.用放大镜观察,颗粒大小为1~100nm的是Fe(OH)3胶体 |
| C.用光束照射,能产生丁达尔现象的是Fe(OH)3胶体 |
| D.看颜色,有色的是Fe(OH)3胶体 |
据报道,一科学小组由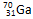 和
和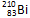 两原子经核聚合,并放出一定数目的中子而制得质量数为275,质子数为114的某原子。则两原子在核聚合过程中放出的中子数目是
两原子经核聚合,并放出一定数目的中子而制得质量数为275,质子数为114的某原子。则两原子在核聚合过程中放出的中子数目是
| A.161 | B.5 | C.166 | D.52 |
熔融烧碱样品应使用下列哪种器皿
| A.石英坩埚 | B.氧化铝耐高温坩埚 | C.生铁坩埚 | D.瓷坩埚 |