有①Na2SO3溶液②CH3COOH溶液③HCl溶液各25 mL,物质的量浓度均为0.1 mol/L。下列说法正确的是( )
| A.三种溶液的pH的大小顺序是①﹥②﹥③ |
| B.三种溶液稀释相同倍数,pH变化最大的是① |
| C.三种溶液中含微粒种类多少顺序是:②﹥①﹥③ |
| D.三种溶液中由水电离出c(H+)大小顺序是:③﹥②﹥① |
如图a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是 ( ) 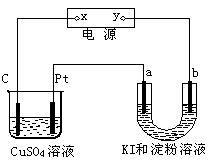
| A.U形管中溶液碱性增强 | B.c上析出红色物质 |
| C.a极和Pt都有气泡产生 | D.x是正极,y是负极 |
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH3
NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
| A.① | B.②④ | C.③④ | D.①②③ |
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(KJ)是( )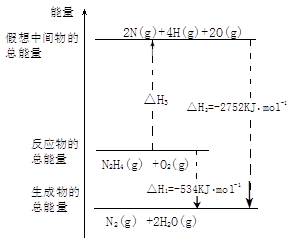
| A.194 | B.391 | C.516. | D.658 |
在下列各说法中,正确的是( )
| A.ΔH>0表示放热反应,ΔH <0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,不能表示分子个数 |
| C.热化学方程式中的ΔH的值与各物质的状态、化学计量数、反应条件均有关 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
将V1 ml 1.0 mol/L HCl溶液和V2 ml未知浓度的NaOH溶液混合均匀后测量并记录溶液的温度,实验结果如图所示(实验中始终保持V1+V2="=50" ml)。下列叙述中不正确的是
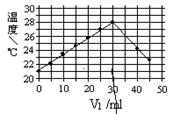
| A.当V1="=30" ml时,盐酸和NaOH溶液恰好完全反应 |
| B.NaOH溶液的浓度约为1.5 mol/L |
| C.做该实验时环境温度为22℃ |
| D.该实验表明化学能可以转化为热能 |