以下各题中各量的关系,请用“﹥”、“=”或“﹤”表示。
(1)pH = 3的醋酸和pH=11的氢氧化钠溶液等体积混合,混合液中c(Na+) c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合,混合液中各离子浓度的大小关系为
(3)常温下,若NaOH溶液中的c(OH-)与NH4Cl溶液中的c(H+)相同。现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH和NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+ pH2 14
(4)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1 、V2 、V3的大小关系
(15分)铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。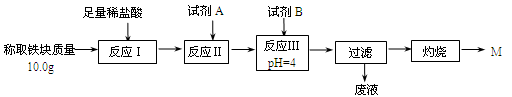
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
|
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
①试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③灼烧完全的标志是 。
④若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
Ⅰ.用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+ KMnO4+ H2SO4→ _CO2↑+ MnSO4 + K2SO4+ H2O
Ⅱ.工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO(同时产生H2),CO和水蒸气在一定条件下发生反应也能制取氢气:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间 |
达平衡时体系能量的变化/kJ |
|||
| CO |
H2O |
CO2 |
H2 |
|||
| ① |
1 |
4 |
0 |
0 |
t1 min |
放出热量:32.8 kJ |
| ② |
2 |
8 |
0 |
0 |
t2 min |
放出热量:Q |
(1)容器①中反应达平衡时,CO的转化率为 。
(2)计算容器②中反应的平衡常数K= 。
(3)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q =" 65.6" kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:
e.平衡时,容器中的转化率:① < ②
Ⅲ.工业上利用用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表: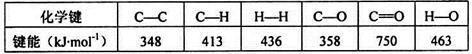
则该热化学反应方程式为 。
Ⅳ.将CH3OH设计成燃料电池,其利用率更高,下图是利用甲醇燃料电池进行某种电化学反应的示意图。
①写出该燃料电池的负极电极方程式 。
②若A、B是石墨电极,X为NaCl溶液,当A极产生22.4L气体(标况下),则理论上消耗CH3OH 克。
③若乙池要实现铁上镀铜,则A电极选择 。
选考【化学-物质结构与性质】(13分)物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)金属钛性能优越,被誉为“第三金属”。
①写出Ti基态原子的电子排布式 。
②月球岩石·玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO2—4的空间构型为 ,其中硫原子采用 杂化。
(2)镍的抗腐蚀性佳,镍属于亲铁元素。
①已知NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____FeO(填“<”或“>”);NiO晶体中Ni2+的配位数为______。
②Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。
(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是_______(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂B.降低温度C.增加H2的浓度
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
①写出阳极电极反应式_____________________________________________________________;
②写出除去甲醇的离子方程式_______________________________________________________。
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图,地壳中含量最高的元素已包含其中。
| Y |
Q |
||||
| X |
Z |
回答下列问题:
(1)Q在元素周期表中的位置是 。X离子的结构示意图为 。
(2)下列选项中,能证明元素非金属性Z强于Y的是 。
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z—,该反应的离子方程式为 。
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为_________________。
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH =_____(已知:T℃,Ksp[Y(OH) n]=4.0×l0-12;lg5=0.7)。