5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下: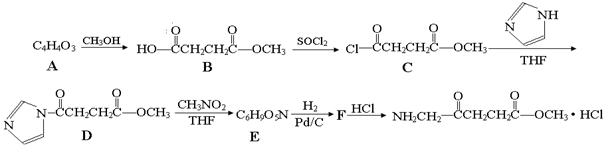
已知: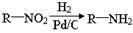
(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为 。
(2)5—氨基酮戊酸盐中含氧官能团的名称是 ,C→D的反应类型为 。
(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式 。
(4)写出D→E的反应方程式 。
(5)已知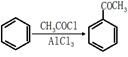 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、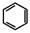 为原料合成
为原料合成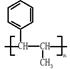 单体的合成路线流程图(无机试剂任选)。
单体的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下: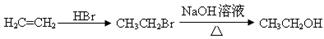
。
甲烷自热重整是先进的制氢方法, 包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气, 发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)  CO2(g)+H2(g)的ΔH= kJ·mol-1。
CO2(g)+H2(g)的ΔH= kJ·mol-1。
(2)在初始阶段, 甲烷蒸气重整的反应速率 甲烷氧化的反应速率(填“大于”、“小于”或“等于”)。
(3)对于气相反应, 用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp), 则反应CH4(g)+H2O(g) CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析, 甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下, 温度、压强对H2和CO物质的量分数的影响如下图: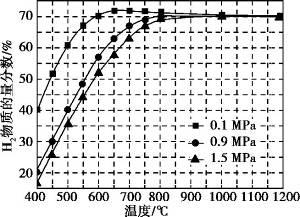
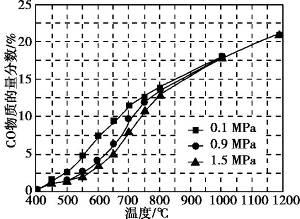
①若要达到H2物质的量分数>65%、CO物质的量分数<10%, 以下条件中最合适的是 。
A.600 ℃, 0.9 MPa B.700 ℃, 0.9 Mpa
C.800 ℃, 1.5 MPa D.1 000 ℃, 1.5 MPa
②画出600 ℃, 0.1 MPa条件下, 系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大, 最终导致H2物质的量分数降低, 原因是 。
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为______________________。
(2)用CH4或其他有机物、O2为原料可设计成原电池,以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为___________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。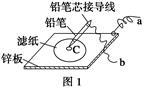

图2电池负极区的电极反应为_________________________;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现_____________色,C位置的电极反应式为___________________若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是__________(填A或B)电极。
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用_______________________________(用必要的离子方程式和文字进行解释)。
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因: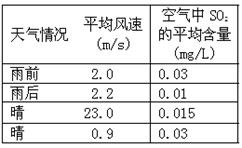
①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下: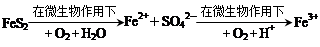
①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。
(6)氧化—还原法消除NOx的转化如下:
①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:
NO2被吸收的离子方程式是 。
酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是________(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能___________(填“失去”或“得到”)_________mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。