(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下: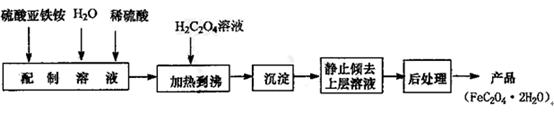
⑴配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是 。
6H2O溶液时,需加少量稀硫酸,目的是 。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。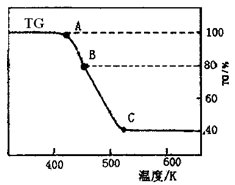
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)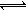 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题: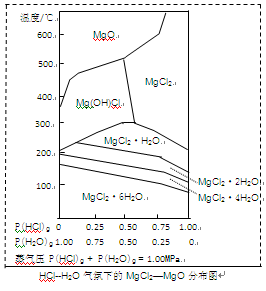
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
某温度下,在2 L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,依图所示:
⑴①该反应的化学方程式是_____________________。
②在t1 min时,该反应达到了__________状态,下列可作为判断反应已达到该状态的是__________
| A.X、Y、Z的反应速率相等 |
| B.X、Y的反应速率比为2︰3 |
| C.生成3 mol Y的同时生成1 mol Z |
| D.生成1 mol Z的同时生成2 mol X |

 ⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为:__________;在此t1 min时间内,用H2表示反应的平均速率v(H2)= __________。
⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为:__________;在此t1 min时间内,用H2表示反应的平均速率v(H2)= __________。 ②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应, 乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
(8分)(1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为____ _ __;
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br] SO4和[Co (SO4) (NH3)5] Br,在第一种配合物的溶液中加BaCl2溶液时,现象是;如果在第二种配合物的溶液中加入BaCl2溶液时,现象是,若在第二种配合物的溶液加入 AgNO3溶液时,现象是。
下图中A~J均代表无机物或其水溶液,其中A是红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。已知B可以在高温下与金属活性不如其强的其他金属的氧化物发生置换反应。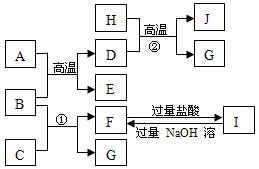
(1)写出下列物质的化学式:
AEI
(2)反应①的离子方程式是E是氧化物(填碱性或酸性或两性)
F与过量盐酸反应的离子方程式是
(3)J与盐酸反应的化学方程式是
反应后的溶液与氯气反应的离子方程式是
有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
(1)A的化学式是
(2)B的化学式是
(3)原白色粉末中一定含有,可能含有,对可能含有的物质,可通过(填实验名称)进一步检验。
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+NH3·H2O  N2H4 +NaCl+H2O
N2H4 +NaCl+H2O
(1)请配平上述化学方程式。并用单线桥法标出电子转移的方向和数目。
(2)NH3·H2O在上述反应中显示出来的性质是。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是,NaClO发生反应。
(4)若生成 0.2 mol N2H4,则转移的电子为mol。