无水硫酸铜在强热下会发生分解反应:
CuSO4 CuO + SO3↑ 2SO3
CuO + SO3↑ 2SO3  2SO2↑+ O2↑
2SO2↑+ O2↑
用下图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量。
实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气。
④再称量D管,得其反应前后的质量差为m。
回答下列问题:
(1) 2SO3(g)  2SO2(g) + O2(g) 该反应的平衡常数表达式为K= 。
2SO2(g) + O2(g) 该反应的平衡常数表达式为K= 。
(2) B管中除温度明显升高外,还可看到的现象是 ,而温度明显升高的主要原因是 ;B管中发生反应的有关离子方程式是 。
(3)仪器E的作用是 。
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为 (用m表示)。
②如果不能,则原因是 。为了能测得分解了的无水硫酸铜的质量,你的简单实验方案是 。
今有一混合物的水溶液,只可能含有以下离子中的若干 种:Na+、NH4+、Cl-、Cu2+、Fe3+、CO32—、SO42—,现每次取100.00ml进行下列实验:
种:Na+、NH4+、Cl-、Cu2+、Fe3+、CO32—、SO42—,现每次取100.00ml进行下列实验:
①第一份加入AgNO3溶液有沉淀产生.
②第二份加足量NaOH后加热,收集到气体0.896L(标准状态下).
③第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩余2.33g.在原溶液中一定存在的离子及其物质的量浓度分别为: _______________.
某实验小组用浓盐酸和MnO2制取并探究Cl2化学性质,设计装置图如下图所示: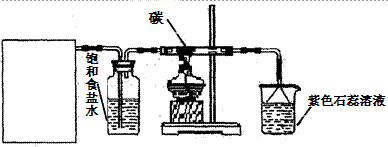
A B C D
(1)A是氯气发生装置(省略未画),制备Cl2的化学反应离子方程式是,A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为
。
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探
究该条件下不能生成氯气的原因。
①提出合理假设
假设1:H+的浓度不够大;
假设2:;
假设3:_________________________ _。
②设计实验方案,进行实验。在答题卷上写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1mol/L稀盐酸、1mol/LAgNO3溶液、淀粉-KI溶液
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2, 。 |
|
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2, 。 |
已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃。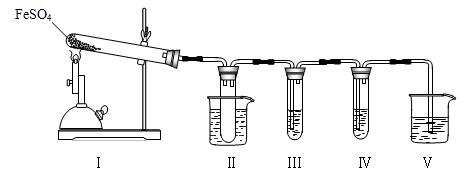
(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________
试管浸泡在50℃的水浴中,目的是______________________________
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:3 mol·L-1 H2SO4、6 mol·L-1 NaOH、0.5 mol·L-1 BaCl2、0.5 mol·L-1 Ba(NO3)2、
0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。
| 检验试剂 |
预期现象和结论 |
| 装置Ⅲ的试管中加入_____________。 |
产生大量白色沉淀,证明气体产物中含有SO3。 |
| 装置Ⅳ的试管中加入________________。 |
______________________________ ______________________________ ______________________________ ______________________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是。
如下图,通电5 min后,电极5质量增加2.16 g,回答: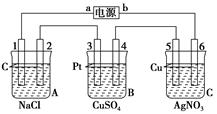
(1)电源:a是________极 ;A池中电极上产生气体能使湿润KI淀粉试纸变蓝;B池中电极上发生氧化反应,电解过程中pH(填增大、减小或不变)。
电池电极反应,电极1:;电极4:。
A池电池总反应。
C池电池总反应。
(2) 如果B池中共收集到224 mL气体(标准状况) ,且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为。
(一)写出有关反应的离子方程式:(1)硫酸氢钠溶液与碳酸氢钠溶液的反应;(2)硫化亚铁投入稀硫酸中反应;
(3)向Na2CO3溶液中加入少量稀盐酸;
(4)向碳酸氢钙溶液中加入少量烧碱溶液 。
(二)(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO、SO中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量B a(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
a(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是___________________________________________;
(2)一定存在的离子是___________________________________________________;
(3)判断沉淀乙成分的方法是。