下列有关实验操作、方法和解释或结论都正确的是
A.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧
B.氯代烃在碱性溶液中水解后用硝酸酸化,再滴加AgNO3溶液,检验氯代烃中的氯原子
C.等体积的pH都为3的酸HA、HB分别与足量的Zn反应,HA放出的H2多,说明酸性:HA>HB
D.为除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂顺序是Na2CO3、Ba(OH)2、盐酸
某小组为研究电化学原理,设计如图装置,下列叙述正确的是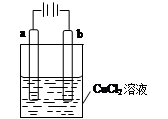
| A.若a和b为石墨,通电后a电极上发生的反应为2Cl--2e-=Cl2↑ |
| B.若a和b为石墨,通电后b电极上发生氧化反应 |
| C.若a为铜,b为铁,通电后a电极质量增加 |
| D.若a为铜,b为铁,通电后Cu2+向铁电极移动 |
下列实验能达到目的的是
| A.用CCl4萃取碘水中的碘 |
| B.将足量盐酸加入混有少量CaCO3杂质的Na2SO4中可除去杂质 |
| C.将混有少量HCl的Cl2通入NaOH溶液中除去HCl |
| D.将Fe(OH)3固体加入沸水中制备Fe(OH)3胶体 |
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
| A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-) |
| D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+) |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。其中Y所处的周期序数与族序数相等。下列说法正确的是
| X |
|||
| Y |
Z |
W |
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.最高价氧化物对应水化物的酸性:Z>W
D.W的最高价氧化物与水反应形成的化合物是离子化合物
下列离子方程式正确的是
| A.氢氧化镁与稀盐酸反应:H+ + OH-=H2O |
| B.AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |