下列有关溶液中微粒的物质的量浓度关系正确的是
A.某酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:
c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合:
c(CN-)+2c(OH-)=2c(H+)+c(HCN)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中: c(NH4+)+ c(NH3·H2O) + c(Fe2+)="0.3" mol·L-1
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是()


A.a为负极、b为正极 |
B.a为阳极、b为阴极 |
C.电解过程中,氯离子浓度不变 |
D.电解过程中,d电极质量增加 |
银锌纽扣电池的总反应式为Zn+Ag2O+H2O Zn(OH)2+2Ag,下列说法不正确的是()
Zn(OH)2+2Ag,下列说法不正确的是()
| A.锌做负极 | B.放电时,正极产物是银 |
| C.电解质溶液不可能呈酸性 | D.充电时发生了原电池反应 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,d质量不断减少,则四种金属的活动性顺序由强到弱的为: ( )。
| A.a > b > c > d | B.a > c > d > b | C.c > a > b > d | D.b > d > c > a |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )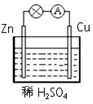
| 2012.3.22, 实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生,发生还原反应 ③ 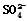 向Cu极移动 向Cu极移动④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu―→Zn ⑥正极反应式:Cu+2e-===Cu2+,发生氧化反应 |
A、①②③ B、②④⑥ C、③④⑤ D、②④
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4燃烧完全后生成CO2和液态H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是()
| A.CH4(g)+2O2(g) = CO2(g)+ H2O(g); ΔH =" —890" kJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH =+890 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH =-890 kJ·mol-1 |
| D.1/2CH4(g)+O2(g)=1/2CO2(g)+2H2O(g); ΔH =-445kJ·mol-1 |