慢心律是一种治疗心律失常的药物,它的合成路线如下: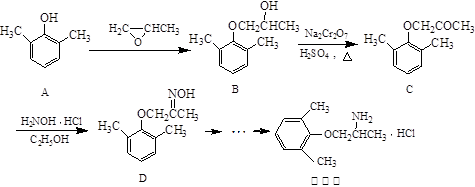
(1)由B→C的反应类型为 。
(2)C分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式: 。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(6)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(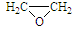 )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚( )和乙醇为原料制备
)和乙醇为原料制备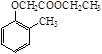 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: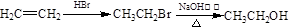
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W,X,Y,Z。
(2)XY2分子中,X原子与Y原子都达到8电子稳定结构,则XY2分子中X和Y原子用于成键的电子数目分别是;根据电子云重叠方式的不同,分子里共价键的主要类型有。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是(写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
按要求回答下列问题
(1)石墨晶体中C-C键的键角为。其中平均每个六边形所含的C原子数为个。
(2)金刚石晶体中含有共价键形成的C原子环,其中最小的C环上有个C原子。
(3)CsCl晶体中每个Cs+周围有个Cl-,每个Cs+周围与它最近且距离相等的Cs+共有个。
(4)白磷分子中的键角为,分子的空间结构为,每个P原子与 个P原子结合成共价键。若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合个氧原子,若每个P原子上的孤对电子再与氧原子配位,就可以得到磷的另一种氧化物(填分子式)。
(5)二氧化硅是一种晶体,每个硅原子周围有个氧原子。
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式__________、___________、_________、______________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是___元素或 ___元素(写元素符号)。
(3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:
_______、________、_________、_______、________、________。
已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,A的相对分子量小于30,在下图变化中,中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,(反应条件未写出)。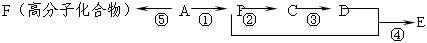
写出下列各步变化的化学方程式,并注明反应条件。
反应①;
反应②;
反应④;
反应⑤;
比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷,该反应的原子利用率为,决定氯乙烷能用于冷冻麻醉应急处理的具体性质是