量取8mL水,应选用__________mL的量筒,视线与液体凹液面的最低处的位置关系是___________(填写“俯视”、“仰视”或“保持水平”), 若仰视量筒读数,实际体积比读数_____________(填“偏大”、“偏小”、“不变”)。
掌握化学实验中常用仪器的特征和用途,有利于开展化学学习和研究,请按要求进行填空:
(1)实验室吸取和滴加少量液体药品时选用的仪器是,在过滤操作中用于引流的玻璃仪器是;
(2)可以直接在酒精灯火焰上加热的仪器是(填两种);
(3)用量筒取用液体药品时,量筒必须放平,视线与量筒内液体保持水平,再读出液体的体积.
如图所示是
、
、
三种固体物质的溶解度曲线: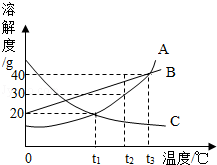
(1)在
℃时,溶解度相等的是两种物质;
℃时将
、
、
三种物质接近饱和的溶液通过降温后,能析出晶体且析出晶体最多的是物质;
(2)当
、
、
三种物质的饱和溶液从
℃降温到
℃,所得的溶液中仍然是饱和溶液的是、两种物质的溶液;
(3)称取
、
、
三种物质各30
分别溶于100
水配成溶液,当温度控制在大于
℃小于
℃时,所得溶液中溶质质量分数最大的是物质的溶液.
有三种元素
、
、
,已知
元素的离子
结构示意图为: ;
元素原子核内只有一个质子,
元素和
元素组成一种氧化物,该氧化物是常用的溶剂.
;
元素原子核内只有一个质子,
元素和
元素组成一种氧化物,该氧化物是常用的溶剂.
(1)
、
、
三种元素可组成一种化合物
,
的化学式是;这种化合物的俗名是(只填一种);
(2)化合物
溶于水所得溶液的
(填"大于"、"小于"或"等于"):化合物
曝露在空气中容易吸收水分,表面
(3)将一种硫酸盐溶液加入到化合物 的溶液中发生反应,有一种蓝色的沉淀生成,写出这一反应的化学方程式:.
在常温常压下有下列物质:①
②
③空气 ④
⑤塑料 ⑥石墨 ⑦
⑧淀粉 ⑨生石灰 ⑩稀硫酸.请回答下列问题(填物质的序号):
(1)被认为是理想的清洁、高能燃料的是、能导电的固体物质是;
(2)属于有机合成材料的是、属于复合肥的是;
(3)属于液体混合物的是、有毒并具有还原性的气体是.
物质是石灰岩的主要成分.
物质经高温分解后得到氧化物
和气体
,
和水反应得到
物质.将
气体通入D物质的澄清溶液中反应,又得到
物质.请你写出
、
两种物质的化学式.并计算出相对分子质量.
物质的化学式、相对分子质量;
物质的化学式、相对分子质量.