汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
| A.反应达到平衡后,NO的反应速率保持恒定 |
| B.使用高效催化剂可有效提高该反应的正、逆反应速率 |
| C.升高温度可使该反应的逆反应速率降低 |
| D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4 OH-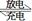 2CO32—+6H2O,则下列说法正确的是
2CO32—+6H2O,则下列说法正确的是
| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O |
| D.放电时,CO32—移向正极 |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量的变化趋势,错误的是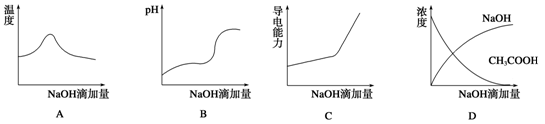
下列说法正确的是
| A.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (OH-)="c" (H+)-c (S2-)+c (H2S) |
| B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后,溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
| C.常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)="c" (CH3COO-)>c (OH-)=" c" (H+) |
| D.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)="2c" (CO32-)+c (HCO3-)+c (H2CO3) |
常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比
| A.11∶1 | B.9∶1 | C.1∶11 | D.1∶9 |
关于下列装置说法正确的是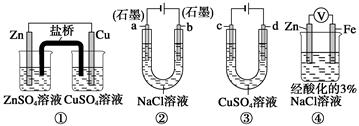
| A.装置①中,盐桥中的K+移向CuSO4溶液装置 |
| B.②工作一段时间后,a极附近溶液的pH减小 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |