(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。
N-H键的键能是 。
(2)发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
N2 (g)+2O2 (g) = 2NO2 (g) △H1=+67.7 kJ·mol-1;
N2H4 (g)+O2 (g) = N2 (g)+2H2O(g) △H2=-534 kJ·mol-1;
H2O(L) = H2O(g) △H3="+44.0" kJ·mol-1。
写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式 :
__________________________________________________________________
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV.TiO2·Xh2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是。II中所采取的操作名称是。
②III中反应的化学方程式是。
③如IV在实验室完成,应将TiO2·xH2O放在(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a. O2→2O b. O2+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是(填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的(填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为。
②当CO气体全部通入后,还要通一会儿空气,其目的是。
在下列物质转化关系中,反应的条件和部分产物已略去。
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是。
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性(填 “强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是。
②反应I的另一种产物为有机物,则该有机物的电子式是。
③反应Ⅱ是化合反应。乙可与硫酸铵共热反应制氨气,则此反应的化学方程式是
。
④在饱和氯水中加块状石灰石,能制得较浓HCIO溶液,同时放出一种气体。其反应的离子方程式是。
高分子化合物Z在食品、医疗方面有广泛应用。下列是合成Z的流程图:
(1)烃A的结构简式是。W中含有的官能团名称是。
(2)X(C3H8O3)分子中每个碳原子上均连有相同的官能团,X的结构简式是。
(3)B为烃。核磁共振氢谱显示:B、D均有三种类型氢原子的吸收峰,且峰面积之比均为1:2:3。则B生成C的化学方程式是。
(4)①Z的单体分子中含甲基,由其生成Z的化学方程式是。
②W可发生加聚反应,生成的高分子化合物的链节是。
(5)戊二酸(HOOC—CH2一CH2一CH2一COOH)是合成树脂的引发剂。现以CH≡CH、CH3CH2OH、HCN为原料,设计合理方案合成戊二酸,用类似合成Z的流程图表示。
提示:
①
②合成过程中无机试剂任选。
【化学—有机化学基础】
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2;有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃基上的一氯取代产物有3种。请回答下列问题:
(1)C的结构简式是 ______________________;
(2)有机物B在Cu作催化剂的条件下与O2 反应生成D,有机物E是D的氧化产物,F是E的一种同分异构体,F可发生如下图所示的转化,其中Y的分子式为C6H8O4且分子中含有一个由六个原子构成的环。
①写出F的结构简式_____________________
②写出由X生成Y的化学方程式________________________________________
③Z在一定条件下可以聚合生成高分子化合物,写出化学方程式。
【化学—物质结构与性质】
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: 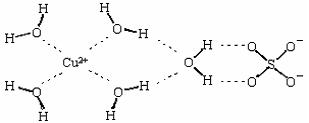
图中虚线表示的作用力为;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是,其中心原子的杂化轨道类型是;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |