下列有关电池的说法不正确的是
| A. | 手机上用的锂离子电池属于二次电池 |
| B. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C. | 甲醇燃料电池可把化学能转化为电能 |
| D. | 锌锰干电池中,锌电极是负极 |
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是()
| A.HCl | B.NaOH | C. NaCl | D.Na2SO4 |
反应H2(g)+I2(g)  2HI(g)的平衡常数为K1;反应HI(g)
2HI(g)的平衡常数为K1;反应HI(g) 1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值()
1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值()
| A.K1=2K2 | B.K1=1/ K22 | C.K1=K22 | D.K1=1/2K2 |
二氧化氮能形成二聚分子:2NO2(g) 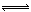 N2O4(g)△H<0。现欲测定二氧化氮的相对分子质量,应采取的措施是()
N2O4(g)△H<0。现欲测定二氧化氮的相对分子质量,应采取的措施是()
| A.低温、高压 | B.低温、低压 | C.高温、低压 | D.高温、高压 |
在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是()
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是()
| A.分子运动速率加快,使反应物分子间的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
| D.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多 |
水的电离过程为H2O  OH-+H+,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是()
OH-+H+,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是()
| A.在35℃,纯水中C(H+)>C(OH-) |
| B.水的电离度α(25℃)>α(35℃) |
| C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
| D.某温度下纯水中C(H+) 为2×10-7 mol/L,则此时的C(OH-) 也为2×10-7 mol/L |