依据氧化还原反应:
设计的原电池如图所示。请回答下列问题:

(1)电极的材料是
(2)银电极为电池的
电极上发生的电极反应为
(3)外电路中的电子是从
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO 浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K =______。
(2)前2s 内的平均反应速率v(CO2)=________。
(3)在上述条件下反应能够自发进行,则反应的△H___0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是____
A.反应混合物各组分物质的量浓度相等
B. NO 、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗lmolNO的同时,就有lmolCO生成
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
如图所示,在不同的电解质溶液中可以组成不同的电池。
(1)①当电解质溶液为稀硫酸时,Fe电极是_____ (填“正”或“负”)极.其电极反应式为______
②当电解质溶液为NaOH溶液时,Al电极是____(填“正”或“负”)极.其电极反应式为______
(2)若把铝改为钢.电解质溶液为浓硝酸,则Fe 电极是_____(填“正”或“负”)极.其电极反应式为______。
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。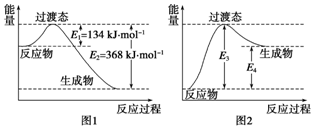
(1)试写出NO2和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4="____" kJ·mol-1
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”“小于”),判断理由是 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。