下列说法中,正确的是( )
| A.硅的化学性质不活泼,在自然界中可以以游离态存在 |
| B.Na2O和Na2O2组成元素相同,且都能与硫酸溶液反应 |
| C.工业上制备镁是用电解熔融的MgO来完成的 |
| D.SO2通入新制氯水中,氯水退色是因为SO2具有漂白性 |
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是()
| A.常温常压下,48gO3含有的氧原子数为3NA |
| B.24g金属镁变为镁离子时失去的电子数为NA |
| C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等 |
下列溶液中Cl-浓度最小的是()
| A.200mL 2mol/L MgCl2溶液 | B.1000mL 2.5mol/L NaCl溶液 |
| C.300mL 5mol/L KClO3溶液 | D.250mL 1mol/L AlCl3溶液 |
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )mol/L
A. |
B. |
C. |
D.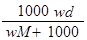 |
实验室中要配制2mol/L的NaCl溶液980 ml,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是()
| A.980 ml ,114.7g | B.500ml, 58.5g |
| C.1000 ml, 117 g | D.1000ml, 117.0g |
某同学用托盘天平称量锌粒24.4g(1g以下用游码),他把锌粒放在右盘,砝码放在左盘,当天平平衡时,所称取的锌粒的实际质量应是:()
| A.24.4g | B.25.5g | C.23.6g | D.24g |