烧杯中盛有100mL1.0mol/L的NaHSO4溶液,向其中逐滴滴加1.0 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法正确的是 ( )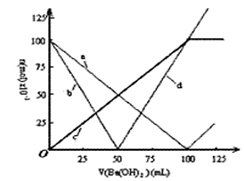
| A.曲线a表示H+的物质的量的变化 |
| B.直线d表示OH-的物质的量的变化 |
| C.曲线c表示Ba2+的物质的量的变化 |
| D.加入Ba(OH)2溶液50mL反应的离子方程式为: |
Ba2+ +OH—+H++SO42-=BaSO4↓+H2O
11.2 g Cu在某浓硝酸中完全溶解,反应产生NO2和NO混合气体3.36L(标准状况),则混合气体中NO2和NO的体积比为
| A.1:l | B.1:2 | C.1:3 | D.2:l |
下列有关溶液组成的描述合理的是
| A.0.1mol·L-1FeCl3溶液中能大量存在Fe2+、NH4+、SCN一、SO42- |
| B.酸性溶液中可能大量存在Na+、ClO一、SO42-、I— |
| C.碱性溶液中能大量存在Mg2+、Cu2+、SO42-、NO3— |
| D.加入铝粉能产生氢气的溶液中可能大量存在NH4+、Fe2+、SO42-、Cl一 |
C、N、S是重要的非金属元素,下列说法正确的是
A.实验室用铜和浓硝酸反应制取NO
B.三种元素均可以和氧元素形成多种氧化物
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.稀硫酸、稀硝酸与铁的反应均属于置换反应
下表中的事实与推论不符的是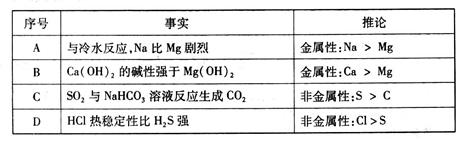
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于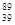 Y的说法错误的是
Y的说法错误的是
| A.属于金属元素 |
| B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 |
D. Y 和 Y 和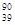 Y 是两种不同的核素 Y 是两种不同的核素 |