某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
[实验1]铜与浓硫酸反应,实验装置如图所示。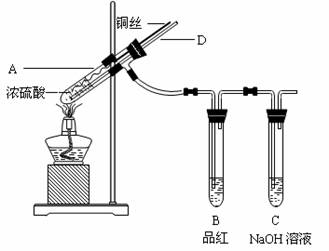
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验: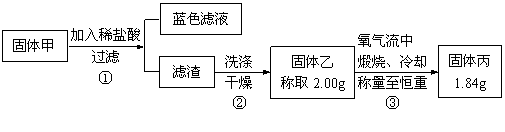
(4)②中检验滤渣是否洗涤干净的实验方法是
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中若存在Cu2O,也可能有Cu2S |
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
| 实验序号 |
金属质量/g |
金属状态 |
c(H2SO4) mol/L |
实验温度/℃ |
金属消失的时间/s |
|
| 1 |
0.10 |
丝 |
0.7 |
20 |
250 |
|
| 2 |
0.10 |
丝 |
1.0 |
20 |
200 |
|
| 3 |
0.10 |
粉末 |
1.0 |
20 |
125 |
|
| 4 |
0.10 |
粉末 |
1.0 |
30 |
50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:。
(2)①实验1、2可得出的结论是;
②实验2、3可得出的结论是;
③实验3、4可得出的结论是。
.(12分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下试验:
(1)取样品 ag ,称取时使用的仪器名称为。
(2)将样品溶于足量的稀盐酸中,过滤,滤渣中含有,在溶解过滤时使用的玻璃仪
器有。
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式。
(4)在第( 3 )步的滤液中通入足量CO2,过滤。有关反应的离子方程式是。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至质量不再减轻为止,冷却后称量,质量为bg,则原样品中铝的质量分数是。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏(填“高”、“低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏;若滤渣燃烧不充分,则实验结果偏。
(5分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si + 3HCl(g) SiHCl3 + H2(g)
SiHCl3 + H2(g)
③SiHCl3与过量H2在1000-1100℃反应制得纯硅:
SiHCl3(g)+ H2(g) Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
已知SiHCl3能与H2O剧烈反应,且在空气中易自燃。
用SiHCI3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)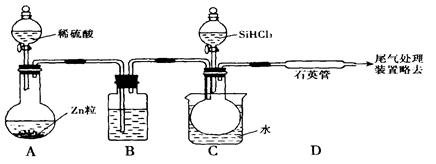
(1)装置B中的试剂是
(2)反应一段时间后,装置D中观察到的现象是,装置D不能采用普通玻璃管的原因是。
(3)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及。
(4)为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是。(填写字母代号)
a.碘水 b.氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定
①用______式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
25.00 |
0.50 |
25.95 |
25.45 |
| 2 |
25.00 |
|||
| 3 |
25.00 |
6.00 |
31.55 |
25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度(注意保留合适的有效数字)。
c(NaOH) = _____________。
(3)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________。(填“无影响”、“偏高”、“偏低”)
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间。
(1)当收集到10mL H2时,哪个实验所耗时间较长?为什么?
_________________________________________________________________________________
(2)活塞外移的情况是_______________。
| A.均匀外移 | B.先快后慢 | C.先慢后快 | D.先慢后快然后又逐渐减慢 |
你选择的理由是___________________________________________________________。