(6分) 水是宝贵的自然资源。请根据下列情况回答问题。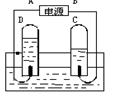

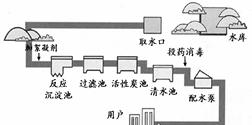
图1 图2 图3
(1)图1是电解水的实验装置。下列有关说法正确的是 。
| A.该实验中,与电源正极相连的玻璃管内得到的气体能在空气中燃烧 |
| B.电解水的实验证明水是由2个氢元素和1个氧元素组成的 |
| C.水电解生成氢气和氧气,说明水中含有氢分子和氧分子 |
| D.在水电解的反应中,氢原子和氧原子都没有发生变化 |
E. 正极与负极产生的气体质量比是2:1
(2)图2是简易净水装置,该净水装置中小卵石、石英砂的作用是 ,净化
后的水是硬水还是软水,生活中可用 加以鉴别。
(3)图3是自来水厂的净水过程示意图,其中活性炭池的作用是 。消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化。高铁酸钠中铁元素的化合价为 价。
(4)水在生产生活中常用于溶解物质形成溶液,实验室所用的某种过氧化氢溶液中,水与过氧化氢的质量比为9:2,则该溶液中氢、氧元素的原子个数比是 。
草酸是一种酸,草酸晶体(H2C2O4•2H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4 + Ca(OH)2= CaC2O4↓(白色)+ 2H2O。
【分析讨论】
(1)草酸的水溶液的pH7(填“>”、“=”、“<”)
(2)实验室可用加热草酸晶体分解的方法获得CO
①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是;
②再将生成的混合气体通过NaOH溶液吸收CO2,其化学方程式是;
③最后用下图装置收集CO,气体应从端进入(选填“a”或“b”)。
【实验反思】
(3)甲认为下图中试管口应略向下倾斜,老师、同学讨论后一致认为装置是正确的,理由是。
(4)实验中观察到澄清石灰水变浑浊,乙认为一定是由草酸晶体受热分解产生的CO2所导致,丙认为乙的结论不严密,理由是。
【生活链接】菠菜营养丰富,但菠菜豆腐同食,易得结石(主要成分:草酸钙晶体),小组同学对草酸钙晶体的性质及组成产生了兴趣。
【性质探究】按下图装置将草酸钙晶体(CaC2O4·xH2O)样品高温加热,使其完全分解并检验产生的气体。
【问题讨论】
(5)B中观察到现象,说明反应生成了水;
(6)C、G中澄清石灰水均变浑浊,说明反应还生成和气体。
(7)反应开始前通入氮气的目的是。
【组成确定】
(8)利用热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图。
①温度为200℃左右时,晶体全部失去结晶水,晶体中结晶水的质量为g。
②计算CaC2O4·xH2O中的x(CaC2O4的相对分子质量:128),x =。
③800℃以上时,经检验残留固体为氧化物,图中m的值是。
④写出固体质量由12.8g变为10.0g时的化学方程式。
下图表示某些物质间转化关系(“→”表示物质之间存在转化关系)。其中A、B是由相同元素组成的无色液体,且A具有消毒杀菌作用;C、F为气体单质,F是空气中含量最高的气体;D、E为固体,D呈红棕色,E是应用最广泛的金属。G的相对分子质量为100,组成元素的原子个数比为3:2 。回答下列问题:
(1)①中D的作用是;
(2)②处利用不同(填序号,A.沸点 B.密度 C.溶解性),分离得两种气体;
(3)反应③④的化学方程式:③;④。
(4)M与NH3可生成尿素[CO(NH2)2],则参加反应的M与NH3的质量比为。
一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验: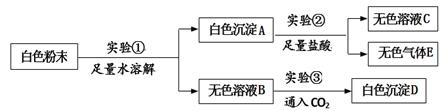
(1)由实验①可知原白色粉末中一定不含有。
(2)由实验②可知原白色粉末中一定含有。
(3)白色沉淀D为,写出实验③的总反应的化学方程式。
(4)根据整个实验还可推断原白色粉末中一定不含。
请根据下列装置,回答问题:
(1)写出有标号的仪器名称:①,②。
(2)用氯酸钾和二氧化锰的混合物制取O2,应选用的发生装置是(填写装置编号),该反应的化学方程式是;若要得到相对纯度更高的氧气一般可用装置收集。
(3)实验室制取CO2的化学方程式是,一般选用的收集装置是,判断CO2已收集满的方法是。
(4)实验室制氢气时,将气体的发生装置由B改进为F,优点是。
高铁酸钾(K2FeO 4)是一种高效的多功能水处理剂。它能与水发生缓慢反应生成一种红褐色的固体和一种使带火星的木条复燃的气体,同时得到的溶液呈碱性。
(1)高铁酸钾中铁元素的化合价:;
(2)高铁酸钾与水反应(计量数分别是4和10)的化学方程式:。