1mol甲烷与氯气发生取代反应,待反应完全后测得四种取代产物的物质的量相等,则消耗的氯气为
| A.0.5mol | B.2mol | C.2.5mol | D.4mol |
硫化氢与二氧化硫反应生成了32g单质硫,则氧化产物和还原产物的质量之比是
| A.1:2 | B.1:3 | C.1:1 | D.2:1 |
玻璃器皿中沾有一些用水洗不掉的下列残留物,其中能用酒精洗干净的是
| A.做有关硫的实验残留的硫 | B.做碘升华实验残留的碘 |
| C.用KMnO4制O2后留下的固体 | D.沾有AgCl沉淀的试管 |
下列各组物质的性质依次递减的是
| A.碱性:Al(OH)3、Mg(OH)2、NaOH | B.还原性:HI、HBr、HCl |
| C.酸性:HClO4、H2SO4、H3PO4 | D.稳定性:H2CO3、NaHCO3、Na2CO3 |
已知0.5molCH4完全燃烧生成二氧化碳和水时,放出445kJ热量,则1molCH4完全燃烧时,断裂反应物分子内的化学键所吸收的总能量与形成生成物分子内的化学键所放出的总能量之间的关系为
| A.前者比后者多890kJ | B.后者比前者多890kJ |
| C.前者比后者多445kJ | D.后者比前者多445kJ |
下列有关化学用语使用正确的是
A.羟基的电子式: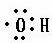 |
B.乙醇的球棍模型: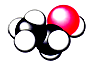 |
| C.乙醛的结构简式:CH3COH | D.蔗糖的分子式: C12H24O12 |