已知反应Cu(s) + 2Ag+(aq) = Cu2+(aq) + 2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是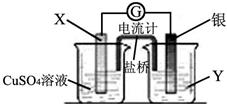
| A.电极X是正极,其电极反应为Cu-2e-=Cu2+ |
| B.银电极质量逐渐减小,Y溶液中c(Ag+)增大 |
| C.实验过程中取出盐桥,原电池仍继续工作 |
| D.当X电极质量减少0.64 g时,外电路中有0.02 mol电子转移 |
有甲、乙两种溶液,甲溶液的pH是乙溶液pH的2倍,则甲溶液中c(H+)与乙溶液中c(H+)的关系是
| A.2:1 | B.100:1 | C.1:100 | D.无法确定 |
已知反应2A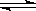 B+3C,在200C进行时其v(A)="5" mol·L-1·s-1。如果温度每升高100C,此反应速率增大到原来的2倍。则当其他条件不变时,温度升至500C时,此反应的化学反应速率v(C)是
B+3C,在200C进行时其v(A)="5" mol·L-1·s-1。如果温度每升高100C,此反应速率增大到原来的2倍。则当其他条件不变时,温度升至500C时,此反应的化学反应速率v(C)是
A.20 mol·L-1·s-1 B.40 mol·L-1·s-1
C.60 mol·L-1·s-1 D.150mol·L-1·s-1
将pH=5的H2SO4溶液稀释500倍,稀释溶液后,c(H+)与c(SO42—)的比值近似为
| A.1:1 | B.1:2 | C.10:1 | D.2:1 |
下列说法或表示方法中正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由单质A转化为单质B ,可知单质B比单质A稳定 ,可知单质B比单质A稳定 |
C.稀溶液中:  |
D.在 、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为 、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为 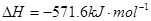 |
可逆反应:3A(g)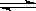 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
| A.若C为固体,则B一定是气体 | B.B和C一定都是气体 |
| C.B和C可能都是固体 | D.B和C不可能都是气体 |