一定温度下可逆反应A(s) + 2B(g)  2C(g) + D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
2C(g) + D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是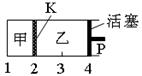
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| B.保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动 |
| C.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少 |
| D.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |