元素周期表里金属元素和非金属元素分界线附近能找到( )
| A.制农药元素 | B.制催化剂元素 |
| C.制半导体元素 | D.制耐高温合金元素 |
有机物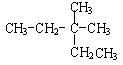 的正确命名为
的正确命名为
| A.2-甲基-2-乙基丁烷 | B.3,3-二甲基戊烷 |
| C.2,2-二甲基戊烷 | D.3-甲基-3-乙基丁烷 |
有关化学用语正确的是
| A.乙烯的实验式 C2H4 | B.乙醇的结构简式 C2H6O |
| C.乙酸的分子式 C2H4O2 | D.四氯化碳的电子式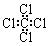 |
上海世博会己于2010年5月1日开幕,本次世博会是一次节能环保新材料的盛宴,其中中国航空馆表面的聚氯乙烯(PVC)(结构式如下图所示)膜厚度仅为0.7毫米,却足以承受一个正常成人的体重。下列关于聚氯乙烯(PVC)的说法正确的是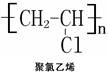
A.由单体合成聚氯乙烯属加聚反应 B.它能使溴水褪色
C.它 易溶于水 D.它有固定的熔沸点
易溶于水 D.它有固定的熔沸点
下列物质中,可以适量地随身携带乘车、船或飞机的是
| A.浓硫酸 | B.高锰酸钾 | C.含Al(OH)3的胃药 | D.食盐 |
下列粒子只具有还原性的是
| A.Cl- | B.Na | C.H+ | D.H2O |