在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
| A.分子运动速率加快,使反应物分子间的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
| D.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多 |
阴离子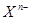 含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是:
含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是:
A.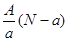 mol mol |
B.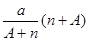 mol mol |
C.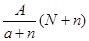 mol mol |
D.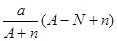 mol mol |
有a、b、c、d四种元素。a、b的阳离子与c、d的阴离子具有相同的电子层结构;a
的阳离子的正电荷数小于b的阳离子的正电荷数,c的阴离子的负电荷数大于d的阴离
子的负电荷数。则它们的离子半径的关系是
| A.a>b>c>d | B.c>d>a>b | C.c>a>d>b | D.b>a>d>c |
下列关于化学键的说法正确的是:
①HF是一种非常稳定的化合物,这是因为分子间存在氢键
②NaCl熔化离子键发生了破坏
③CO2、SiO2熔点后者高是因为前者克服分子间作用力后者熔化破坏共价键
④活泼金属与非金属化合时,一定能形成离子键
⑤离子化合物中可能同时含有离子键和共价键
⑥由非金属元素形成的化合物一定不是离子化合物
⑦单质分子中一定含非极性键
| A.①②⑤ | B.④⑥⑦ | C.①③④ | D.②③⑤ |
右边是周期表中的短周期的一部分,若这些元素的原子之间均能形成共价键,则形成的共用电子对偏移程度最小的是: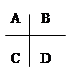
| A.BC | B.BD | C.AD | D.AB |
水和重水分别跟金属钾反应,若两反应中电子转移总数相等时,下列物质的化学量相等的是:①消耗水和重水的质量;②同温同压下生成气体的体积;③生成气体的质量; ④参加反应的钾的质量。
| A.①③ | B.②④ | C.①④ | D.②③ |