用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A.HCl | B.NaOH | C. NaCl | D.Na2SO4 |
常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸混合,在混合溶液中:n(NH4+ )+n(H+)-n(OH-) =" b" mol。则a、b正确的答案组合是()
| A.9-11之间;0.1 | B.9-11之间;0.2 |
| C.12-13之间;0.2 | D.13;0.1 |
在二氧化碳的水溶液中存在着如下平衡:
C02(g) C02(aq) C02(aq)+H20
C02(aq) C02(aq)+H20 H2C03(aq)
H2C03(aq)
H2C03(aq) H+ (aq)+HCO3-(aq) HCO3-(aq)
H+ (aq)+HCO3-(aq) HCO3-(aq)  H+(aq)+CO32-(aq)
H+(aq)+CO32-(aq)
下列有关说法正确的是()
| A.水中溶解的二氧化碳的浓度,夏天时比冬天时高 |
| B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高 |
| C.气压升高,水中c(HCO3-)增大 |
| D.常温下,二氧化碳的水溶液中,由水电离出的c(H+)与c(OH-)的乘积等于1×lO-14 |
将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是()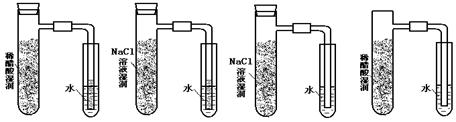 A B C D
A B C D
下列化学反应的离子方程式正确的是()
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH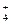 +HCO +HCO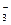 |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3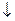 +2HClO +2HClO |
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S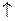 |
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO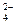 =CaSO4 =CaSO4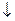 +H2O +H2O |
下列实验操作正确的是()
| A.减压过滤完毕,先关闭水龙头,后拆下连接抽气泵和吸滤瓶的橡皮管,防止倒吸 |
| B.萃取与分液的操作中,将上层液体从分液漏斗下口放出 |
| C.滴加H2SO4、KI、淀粉溶液,鉴别NaNO2和NaCl |
| D.向AgNO3溶液中依次滴加同浓度的Na2S、KI、NaCl溶液,实现沉淀的转化 |