一定温度下,发生如下反应:2X(g) + Y(g)  a Z(g) + W(g) △H =" -Q" kJ·mol-1 (Q>0)
a Z(g) + W(g) △H =" -Q" kJ·mol-1 (Q>0)
在一体积固定的密闭容器中加入2 mol X和1 mol Y,当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则(1)温度升高,平衡常数K的值是 (填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为 。(3) Q1 Q (填“>”、“<”或“=”)
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
| A.2 molX、1mol Y、1molAr | B.a molZ、1mol W |
| C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W | D.2 molX、1mol Y、1molZ |
下列分子结构图中的大黑点表示原子序数小于10的元素的“原子实”(指原子除去最外层电子的剩余部分),小黑点表示没形成共价键的最外层电子,短线表示共价键。其中分子结构图与化学式关系错误的是
A.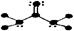 (C3H4O) (C3H4O) |
B. (HCN) (HCN) |
C.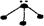 (NH3) (NH3) |
D.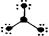 (BF3) (BF3) |
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,则下列叙述中正确的是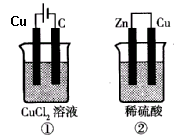
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①不变②增大 |
| C.①和②中铜电极均失电子 |
D.电极反应式:①中阳极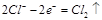 ②中负极 ②中负极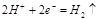 |
甲、乙两种金属性质比较:①甲的单质熔、沸点比乙的低;②常温下,甲能与水反应放出氢气而乙不能;③最高价氧化物对应的水化物碱性比较,乙比甲的强;④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡。上述项目中能够说明甲比乙的金属性强的是
| A.①② | B.②④ | C.②③ | D.①③ |
已知一定温度时:N2(g)+3 H2(g) 2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入3mol H2和1mol N2,达到平衡时放出热量为Q,则下列关系式中正确的是
2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入3mol H2和1mol N2,达到平衡时放出热量为Q,则下列关系式中正确的是
| A.Q=92 kJ | B.Q< 92 kJ | C.Q> 92 kJ | D.Q<92×2 kJ |
取5 mL 0.1 mol·L-1KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴,继续加入2 mLCCl4,充分振荡,静置。下列有关该实验的说法不正确的是
| A.下层CCl4溶液呈紫红色 |
| B.取少量上层溶液,滴加酸性AgNO3溶液,若有黄色沉淀产生,则表明该反应存在化学反应限度 |
| C.取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度 |
| D.该实验中KI与FeCl3反应后(未加CCl4),溶液中存在Fe3+、Fe2+、I—、I2等微粒 |