关于下列四个图像的说法中正确的是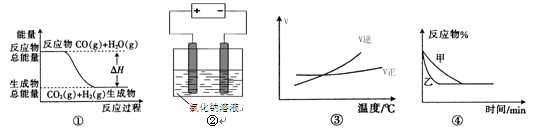
A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH小于0 CO2(g)+H2(g)”中的ΔH小于0 |
| B.图②是在长时间电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1 |
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH大于0 2AB3(g)”的ΔH大于0 |
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是( )。
A.2SO3(g) 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
已知:①CH3OH (g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+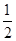 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+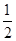 O2(g)===CO2(g)+2H2(g)的 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
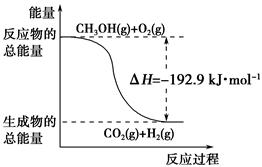
| D.反应②中的能量变化如下图所示 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ·mol-1、ΔH=-285.8 kJ·mol-1、ΔH=-890.3 kJmol-1、ΔH=-2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )。
A.C(s)+ O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D. C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.生成物总能量一定低于反应物总能量 |
| B.酒精可用作燃料,说明酒精燃烧是释放能量的反应 |
| C.干冰气化需要吸收大量的热,这个变化是吸热反应 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |