爱迪生蓄电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
下列该蓄电池推断错误的是:
①放电时,Fe参与负极反应,NiO2参与正极反应
②充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-=" Fe" + 2OH-
③放电时,电解质溶液中的阴离子向正极方向移动
④放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
| A.只有③ | B.③④ | C.④⑤ | D.①②⑤ |
下列物质中,属于电解质且能导电的是
| A.石墨 | B.硫酸溶液 | C.熔融氯化钠 | D.固态氯化钾 |
下列物品主要含氧化铝的是
| A.耐火坩埚 | B.砖瓦 | C.玛瑙手镯 | D.水晶镜片 |
下列仪器中可直接加热的是
| A.烧杯 | B.试管 | C.量筒 | D.圆底烧瓶 |
下列物质能放在食品包装袋内的小袋中,以防止食品因被氧化而变质的是
| A.硅胶 | B.生石灰 | C.活性炭 | D.铁粉 |
将V L AlCl3和KCl的混合溶液均分成两份,一份滴加氨水,使Al3+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(K+)为
A.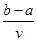 mol/L mol/L |
B.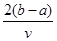 mol/L mol/L |
C.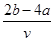 mol/L mol/L |
D.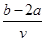 mol/L mol/L |