I2在KI溶液中存在下列平衡:I2(aq) + I-(aq)  I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1100 |
841 |
680 |
533 |
409 |
下列说法正确的是:
A.反应I2(aq)+I-(aq) 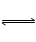 I3-(aq)的△H>0
I3-(aq)的△H>0
B. 其他条件不变,加入KI固体平衡向正反应方向移动,所以溶液中c(I-)减小
C. 其他条件不变,升高温度,溶液中c(I3-)减小
D.25℃时,向溶液中加入少量KI固体,平衡正向移动,平衡常数K会大于680
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C.由X元素形成的单质有的可以导电 |
| D.由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
下列各组物质中,化学键的类型相同的是( )
| A.CaCl2和Na2S | B.Na2O和Na2O2 |
| C.N2和Ne | D.HCl和NaOH |
以下说法正确的是( )
| A.共价化合物内部可能有极性键和非极性键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.金属元素与非金属元素的原子间只形成离子键 |
下列说法正确的是()
| A.原子的L层上的电子数为奇数的元素一定是主族元素 |
| B.同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1 |
| C.相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类 |
| D.主族序数等于周期序数的元素一定为金属元素 |
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是()
| A.MgF2 | B.MgCl2 | C.CaCl2 | D.CaBr2 |