已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOH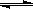 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
| A.加少量CH3COONH4固体 | B.降低温度 | C.加少量NaOH固体 | D.加水稀释 |
常温时,将足量的AgCl固体分别加入同体积的下列各溶液中,溶解的AgCl最少的是( )。
| A.1 mol·L-1的MgCl2溶液 | B.2 mol·L-1的NaCl溶液 |
| C.1.4 mol·L-1的BaCl2溶液 | D.1 mol·L-1的AlCl3溶液 |
下列说法正确的是()。
| A.凡是放热反应都是自发的 | B.铁在潮湿空气中生锈是自发过程 |
| C.熵增大的反应都是自发反应 | D.电解池的反应是属于自发反应 |
下列实验操作与安全事故处理均正确的是()
①做银镜反应实验后的试管内壁附有银,可用氨水清洗
②配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒
③欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液
④将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体
⑤使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
⑥用试管夹从试管底由下往上夹住距试管口约1/3处,手持试管夹长柄末端,进行加热
⑦制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
⑧把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中
A.①③④⑥ B.②⑤⑥⑦ ③⑤⑥⑧ D.⑤⑥⑦⑧
③⑤⑥⑧ D.⑤⑥⑦⑧
将Mg和Cu组成的混合物11.2g完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入过量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是()
A.0.3molNO2B.0.2molNO2和0.1molN2O4 0.1molNO、0.2molNO2和0.05molN2O4D.0.6molNO
0.1molNO、0.2molNO2和0.05molN2O4D.0.6molNO