哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是 ( )
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
下列有关Na2CO3和NaHCO3的说法中正确的是 ( )
| A.两者在医疗上均可用于治疗胃酸过多 |
| B.它们都易溶于水 |
| C.在通常状况下,受热都易分解 |
| D.都可以和NaOH溶液反应 |
欲除去Na2CO3固体中的NaHCO3杂质,可采取的方法是( )
| A.加水溶解后过滤 |
| B.配成溶液后通入足量的CO2气体 |
| C.将固体加热 |
| D.先加足量盐酸后过滤 |
取ag某物质在氧气中完全燃烧,某产物跟过量的Na2O2固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是(提示:C6H12O6、C2H6O完全燃烧产物都为CO2、H2O) ( )
| A.H2 | B.CO | C.C6H12O6 | D.C2H6O |
有15 g Na2O2、Na2O、NaOH的混合物与400 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为 ( )
| A.23.4 g | B.25.5 g | C.31 g | D.无法计算 |
已知用金属钠制取氧化钠的方法有许多,下列方法最好且解释合理的是 ( )
A.4Na+O2(纯)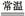 2Na2O:产物唯一,条件易控制 2Na2O:产物唯一,条件易控制 |
B.4Na+CO2 2Na2O+C:原料价廉,反应操作简便 2Na2O+C:原料价廉,反应操作简便 |
C.2NaNO2+6Na 4Na2O+N2↑:产物中只有Na2O固体生成,且生成的N2可将周围环境中的O2排净,保护Na2O不被进一步氧化 4Na2O+N2↑:产物中只有Na2O固体生成,且生成的N2可将周围环境中的O2排净,保护Na2O不被进一步氧化 |
D.4Na+O2(空气)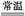 2Na2O:操作简便 2Na2O:操作简便 |