根据
(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=Cu2++2Fe2+
(3)2Fe2++Cl2=2Fe3++2Cl- (4)HClO+H++Cl-=H2O+Cl2,
可以判断出各粒子的氧化性由强到弱的顺序正确的是
| A.HClO>Cl2>Fe3+>Cu2+ | B.Cl2>HClO>Fe3+>Cu2+ |
| C.Cl2>Fe3+>HClO>Cu2+ | D.HClO>Cl2>Cu2+>Fe3+ |
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是
| 物质 |
杂质 |
除杂试剂或操作方法 |
|
| ① |
酒精 |
水 |
蒸馏 |
| ② |
H2 |
CO2 |
通过盛有NaOH溶液洗气瓶,再通过盛有浓硫酸洗气瓶 |
| ③ |
NaNO3 |
CaCO3 |
溶解、过滤、蒸发 |
| ④ |
NaCl |
I2 |
加热 |
| ⑤ |
KNO3溶液 |
AgNO3 |
加入NaCl溶液,过滤 |
A. ① ④ ⑤ B. ③ ④ ⑤ C. ① ② ③ ④ D. ① ② ③ ⑤
要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验
| A.Fe、CuSO4溶液、MgCl2溶液 | B.Fe、MgCl2溶液、FeCl2溶液 |
| C.Mg、CuO、FeSO4溶液 | D.Cu、FeCl2溶液、MgCl2溶液 |
下列说法正确的是
| A.焰色反应实验后,用稀硫酸洗净铂丝,灼烧至无色,以除去残留在铂丝上的试剂 |
| B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+ |
| C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| D.托盘天平称取58.50g食盐,加1升水配制成溶液,NaCl溶液浓度为1mol·L-1 |
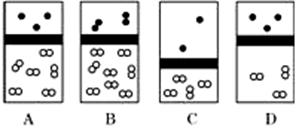
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是