下列离子方程式书写正确的是
| A.硫酸亚铁溶液中加入过氧化氢溶液:Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O |
| B.氯化铝溶液中加入过量氨水:Al3++ 3 NH3·H2O = Al(OH)3↓ + 3 NH4+ |
| C.次氯酸钙溶液中通入过量的二氧化碳:Ca2+ +2ClO—+ H2O + CO2 = CaCO3↓+ 2HClO |
| D.在氨水中通入少量的二氧化硫反应:NH3·H2O + SO2 = NH4+ + HSO3— |
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下的气体0.224 L。则下列判断中正确的是
| A.向溶液中滴入KSCN溶液,显血红色 |
| B.原混合物中n(Fe)∶n(Fe2O3)=2∶1 |
| C.无法计算原混合物的质量 |
| D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
下列各反应的化学方程式或离子方程式中,不正确的是
A.将点燃的镁条伸入充满CO2气体的集气瓶中:2Mg + CO2 2MgO+C 2MgO+C |
| B.大理石溶于醋酸:CO3 2- + 2CH3COOH = 2CH3COO- + CO2↑+ H2O |
| C.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全: Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O |
| D.向淀粉KI溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝: |
4H+ +4I- + O2 = 2I2 +2H2O
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则下列选项不正确的是
| A.ρ="(17V+22400" )/ (22.4+22.4V) |
| B.用水稀释该溶液,OH—的物质的量增加 |
| C.该溶液中共有6种微粒 |
| D.C=1000Vρ/(17V+22400) |
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是
| A.FeBr2与Cl2 | B.Ba(OH)2与H2SO4 |
| C.HCl与Na2CO3 | D.NaHCO3与Ca(OH)2 |
下列实验不合理的是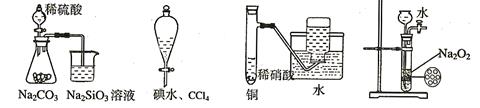
A B C D
| A.证明非金属性强弱 S>C>Si | B.四氯化碳萃取碘水中的碘 |
| C.制备并收集少量NO气体 | D.制备少量氧气 |