A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)①A原子的结构示意图为 ,
②B原子的电子式为 ,
③D的氢化物的电子式为 ,
④E的最高价氧化物的化学式为 。
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A、B最高价氧化物对应水化物相互反应的化学方程式:
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示):
(1)有两种芳香烃结构如下:
萘: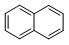 联苯:
联苯: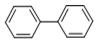
它们的分子式分别为 和。
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为____________ ,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______________。
下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
(1)2-甲基丁烷和丁烷 ________________
(2)正戊烷和2,2-二甲基丙烷___________________
(3)间二甲苯和乙苯_____________________
(4)1-已烯和环已烷____________________________
(1)同系物,(2)同分异构体,(3)同分异构体 (4)同分异构体
28.分子结构中含有两个-CH3、一个-CH2-、一个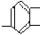 基、一个 -OH,且属于酚类的同分异构体有6种,其结构简式为:__________、_________、_________、_________、_________、__________。
基、一个 -OH,且属于酚类的同分异构体有6种,其结构简式为:__________、_________、_________、_________、_________、__________。
按要求完成下列问题
(1)甲基的电子式________ _____
(2)氢的质量分数最高的有机物的分子式
(3)相对分子质量为72且沸点最低的烷烃的结构简式
(4)1,3-丁二烯的键线式
(5)含有一个手性碳原子且式量最小的的烯烃的结构简式是:
(6) 和Br2 按物质的量之比1:1发生加成反应时,可得
和Br2 按物质的量之比1:1发生加成反应时,可得
到种产物。和HBr按物质的量之比1:1发生加成反应时,可得到
种产物。
(7)写出和 相关的异构体,各举出一例,
相关的异构体,各举出一例,
位置异构:顺反异构:类别异构:。
甲、乙、丙、丁分别是乙烷、乙烯、乙炔、苯中的一种;
⑴、甲、乙能使溴水褪色。乙与等物质的量的H2反应生成甲,甲与等物质的量的H2反应生成丙。
⑵、丙既不能使Br2的CCl4溶液褪色,也不能使KMnO4酸性溶液褪色。
⑶、丁既不能使Br2的CCl4溶液褪色,也不能使KMnO4酸性溶液褪色,但在一定条件下可与溴发生取代反应。1 mol丁可以和3 mol H2完全加成。
据以上叙述完成下列填充:
甲的结构简式____________________乙的结构式_________________
丙的电子式________________
丁与溴发生取代反应的方程式_____________________________________________