为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
| A.甲 | B.乙 | C.丙 | D.上述实验方案都不正确 |
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72->Fe3+>SO2 |
| B.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断错误的是
| A.气体甲可能是混合物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.白色沉淀乙的主要成分是氢氧化铝 |
| D.K+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素。下列说法错误的是
| W |
Z |
|
| X |
Y |
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<W
D.W、Z的氧化物都能与碱反应生成盐和水
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。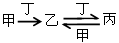
下列推断错误的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为N2,则丙可能是NO2 |
| C.若甲为Cl2,则丁可能是Fe |
| D.若甲为NaOH溶液,则丁可能是CO2 |
下列表述或化学用语书写正确的是
| A.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性: Ba2++OH-+H++SO2- 4=BaSO4↓+H2O |
| B.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
D.金属铝与氧化镁发生铝热反应:2Al+3MgO 3Mg+Al2O3 3Mg+Al2O3 |