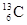 -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,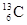 表示的是( )
表示的是( )
| A.核外有13个电 子,其中6个能参与成键 |
| B.核内有6个质子,核外有7个电子 |
| C.质量数是13,原子序数是6,核内有7个质子 |
| D.质量数是13,原子序数是6,核内有7个中子 |
在一密闭容器中盛有2molNa2O2与2molNaHCO3,将其加热到150℃,经充分反应后,容器内残留的固体是
| A.1molNa2CO3和2molNaOH | B.2molNa2CO3和2molNaOH |
| C.2molNa2CO3和1molNa2O2 | D.只有2molNa2CO3 |
把2.1g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
| A.7.2g | B.3.6g | C.2.1 | D.无法确定 |
同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
| A.x∶y等于甲与乙的相对分子质量之比 |
| B.x∶y等于等质量的甲与乙的分子个数之比 |
| C.x∶y等于同温同压下甲与乙的密度之比 |
| D.y∶x等于同温同体积下等质量的甲与乙的压强之比 |
运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P =3P2O5+5KC1。下列有关该反应的叙述中,正确的是
| A.氯酸钾是还原剂 |
| B.反应中消耗3molP时,转移电子的物质的量为15mol |
| C.KCl既是氧化产物,又是还原产物 |
| D.发令时产生的白烟只是KC1固体颗粒 |
已知反应式:①H2S+I2=S↓+2H++2I-②H2SO3+2H2S=3S↓+3H2O③2I-+Br2=I2+2Br-
④H2SO3+I2+H2O=SO42-+2I-+4H+,下列各组中还原性由强到的是
| A.H2S、H2SO3、I-、Br- |
| B.I-、Br-、H2SO3、H2S |
| C.H2S、I-、Br-、H2SO3 |
| D.I-、Br-、H2S、H2SO3 |