下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A.SiO2 CaCl2 CBr4CF4 | B.SiO2CsCl CF4CBr4 |
| C.CsCl SiO2 CBr4CF4 | D.CF4CBr4CsCl SiO2 |
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
| A.原子最外层电子数由多到少的顺序:Y、X、W、Z |
| B.原子半径由大到小的顺序:W、Z、Y、X |
| C.元素非金属性由强到弱的顺序:Z、W、X |
| D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
常温下,某未知溶液中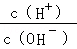 =1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检验就能加以否定的离子是
=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检验就能加以否定的离子是
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层
结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
| A.元素的非金属性次序为c>b>a |
| B.a和其他3种元素均能形成共价化合物 |
| C.d和其他3种元素均能形成离子化合物 |
| D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6 |
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3②(NH4)2SO3③Al2O3④Al(OH)3⑤Al ⑥NaAlO2
| A.全部 | B.只有①③④⑤ |
| C.只有③④⑤⑥ | D.只有①②③④⑤ |
下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |