近期北京大学的两位教授率先发现体内有微量H2S存在于心肺血管中,它对调节心血管功能具有重要作用。下列叙述正确的是( )
| A.H2S受热很难分解 |
| B.H2S分子中所有原子都达到8电子的稳定结构 |
| C.H2S气体通入溴水中会使溴水褪色 |
| D.H2S是电解质,其电离方程式为H2S=2H++S2— |
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是()
| A.Na2CO3、NaHCO3、NaCl、NH4Cl |
| B.NH4Cl、NaCl 、Na2CO3、NaHCO3 |
| C.(NH4)2SO4、NH4Cl、NaNO3、Na2S |
| D.NH4Cl 、(NH4)2SO4、Na2S 、NaNO3 |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为
0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中正确的是()
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS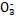 )>c(S
)>c(S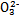 )>c(OH-)
)>c(OH-)
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A.x=10-2y | B.x >y | C.x=y | D.x=102y |
在18 ℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是 ( )
| A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |
下列离子方程式正确的是( )
A.碳酸氢钠水解:HCO3-+ H2O H3O+ + CO32- H3O+ + CO32- |
B.醋酸铵溶于水:CH3COONH4 + H2O CH3COOH + NH3·H2O CH3COOH + NH3·H2O |
| C.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++ SO42-+ Ba2++OH-=BaSO4↓+ H2O |
D.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq) CaCO3(s) + SO42-(aq) CaCO3(s) + SO42-(aq) |