下列排序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HCl O4 ④结合H+的能力:OH—>CH3COO—>Cl—
| A.①③ | B.②④ | C.①④ | D.②③ |
在甲酸的下列性质中,可以证明它是弱电解质的是()
| A.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
| B.甲酸能与水以任意比互溶 |
| C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D.甲酸的导电性比强酸溶液的导电性弱。 |
已知H+(aq)+OH-(aq)=H2O(l);ΔH=" -57.3" kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是()
| A.Q1<Q3<Q2 | B.Ql<Q2<Q3 | C.Q1<Q2=Q3 | D.Q1=Q2=Q3 |
下列各种环境下的离子组合中,离子不能大量共存的是()
| A.无色中性溶液:Mg2+、Al3+、SO42-、Cl- |
| B.pH=0溶液:Al3+、NH4+、Mg2+、HSO4- |
| C.[H+]=10-10mol/L溶液:Na+、AlO2-、S2-、S2O32- |
| D.[H+]>[OH-]的溶液:Fe3+、ClO-、I-、NO3- |
在恒温时,一固定容积的容器内发生反应:PCl5(g) PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
| A.增大 | B.减小 | C.不变 | D.无法判断 |
下列变化不能用勒夏特列原理解释的是( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
B.已知反应H2(g) + I2(g)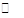 2HI(g)达平衡,加压后混合气体颜色变深 2HI(g)达平衡,加压后混合气体颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |