下列方程式正确的是( )
| A.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+ |
| B.向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-△NH3↑+H2O |
| C.Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++ SO42-=BaSO4↓ |
| D.往NaOH溶液通入过量SO2: SO2+2OH-=SO32-+H2O |
下列实验操作或装置(略去部分加持仪器)正确的是()



下列叙述正确的是( )
| A.配制100mL1.0mol/LCuSO4溶液:将25gCuSO4∙5H2O溶于100mL蒸馏水中 |
| B.配制6mol/L100mL硫酸时,定容后应将容量瓶沿顺时针方向摇匀 |
| C.盛放NaOH溶液时,使用带玻璃塞的磨口瓶 |
| D.可以采用溶解、蒸发浓缩、冷却结晶、过滤的方法分离NaCl和KNO3固体混合物 |
下列有关说法正确的是( )
| A.常温常压下,78gNa2O2中含有的阴离子数是NA |
B. m g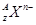 中所含电子数为(Z-n)mNA/A 中所含电子数为(Z-n)mNA/A |
| C.1L0.1mol/LFe(OH)3胶体中含有Fe(OH)3胶粒数为0.1NA |
| D.H2SO4的摩尔质量为98 |
下列有关说法不正确的是( )
| A.硫(俗称硫磺)是一种黄色晶体,质脆。不溶于水,易溶于酒精 |
| B.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 |
| C.氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 |
| D.FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe3O4 |
下列无色溶液中可以大量共存的是( )
| A.K+、Na+、MnO4-、SO42- |
| B.I-、Na+、NO3-、ClO- |
| C.Mg2+、Na+、NO3-、SO42- |
| D.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |