升高温度能加快反应速率的主要原因是
| A.活化分子能量明显增加 | B.降低活化分子的能量 |
| C.增加活化分子百分数 | D.降低反应所需要的能量 |
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下图所示: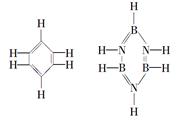
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
| A.2 | B.3 | C.4 | D.6 |
下列说法正确的是 ( )
①参加反应的物质的性质是影响化学反应速率的主要因素②光是影响某些化学反应速率的外界条件之一③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率
| A.①② | B.②③ | C.③④ | D.①④ |
下列关于煤、石油、天然气等资源的说法正确的是 ( )
| A.石油裂解得到的汽油是纯净物 | B.石油产品都可用于聚合反应 |
| C.天然气是一种清洁的化石燃料 | D.水煤气是通过煤的液化得到的气体燃料 |
若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生酯化反应,一段时间后,分子中含有18O的物质有 ( )
| A.1种 | B.2种 | C.3种 | D.4种 |
下列有关环境问题的说法正确的是( )
| A.燃烧煤时加入适量石灰石,可减少废气中SO2的量 |
| B.臭氧的体积分数超过10-4%的空气有利于人体健康 |
| C.pH在5.6~7.0之间的降水通常称为酸雨 |
| D.含磷的合成洗涤剂易于被细菌分解,故不会导致水体污染 |