“酸化”是实验中经常采用的方法,下列酸化过程正确的是
| A.抑制Fe2+的水解,用稀硝酸酸化 |
| B.提高高锰酸钾的氧化能力,用盐酸酸化 |
| C.确认溶液中含有SO42-时,用盐酸酸化,再检验 |
| D.检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化,再检验 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb下列有关说法正确的是:(Pb的相对原子质量:207)
| A.正极反应式:Ca+2Cl- - 2e-=CaCl2 |
| B.常温时,在正负极间接上电流表或检流计,指针不偏转。 |
| C.放电过程中,Li+向负极移动 |
| D.每转移0.1mol电子,理论上生成20.7gPb |
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是
| A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中碳碳双键、酚羟基两种基团至少存在一种。 |
| C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol |
| D.该分子中的所有碳原子不可能共平面 |
下列图示与对应的叙述相符的是: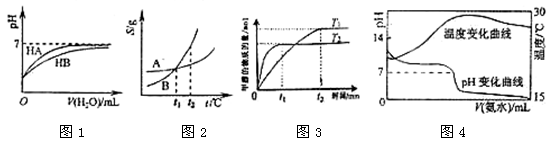
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 |
现象 |
结论 |
|
| A |
先滴加BaCl2溶液,再加稀HNO3 |
生成白色沉淀,且沉淀不溶解。 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫红色 |
原溶液中有I― |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加NaOH溶液加热,将红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.碱性溶液中:ClO-、Cl-、K+、Na+ |
| B.常温常压下气体:O2、N2、Cl2、NH3 |
| C.含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D.氢氧化铁胶体:H+、K+、S2-、Br- |