在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s) + 5O2(g) = P4O10(s);ΔH=-3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s);ΔH =-2954.0 kJ·mol-1
由此判断下列说法正确的是( )
| A.红磷的燃烧热为2954.0 kJ·mol-1 |
| B.已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′ |
| C.由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高 |
| D.等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多 |
下列各表述与示意图一致的是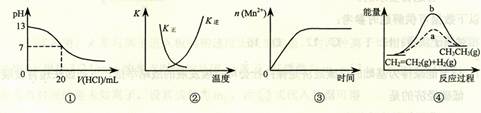
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时(ΔH >0),n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
M是一种冶疗艾滋病的新药(结构简式见右图),已知M分子中-NH-COO-基团
(除H外)与苯环在同一平面内,关于M的以下说法正确的是 
| A.该物质易溶于水 |
| B.M能发生加聚反应 |
| C.M的分子式为C13H12O2NF4 |
| D.M分子内至少有13个碳原子在同一平面内 |
某恒温密闭容器发生可逆反应Z(?)+W(?) X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
| A.Z和W在该条件下一定不为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X 浓度相等 |
| D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③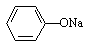 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)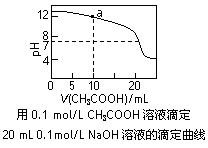
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+ H2O(未配
H2O(未配 平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是()
平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是()
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |