现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
硫酸 |
| pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(SO42-)>c(OH-)>c(H+)
LiNi0.25Co0.75O2是锂离子电池的一种高性能的二元正极活性材料,其制备原理可表示为4Ni0.25Co0.75(OH)2+4LiOH+O2=4LiNi0.25Co0.75O2+6H2O(已知Ni与Co的化合价均有+2和+3)。下列说法不正确的是( )
| A.Ni0.25Co0.75(OH)2中Ni的化合价是+2 |
| B.LiNi0.25Co0.75O2中Co的化合价是+3 |
| C.该反应中LiOH是还原剂 |
| D.该反应中O2是氧化剂 |
下列离子方程式不正确的是( )
| A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
| B.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3—+H+=H2O+CO2↑ |
| C.过量Na投入AlCl3溶液:Al3++4Na+2H2O=AlO2—+4Na++2H2↑ |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:2Ba2++Al3++2SO42—+4OH-=AlO2—+2BaSO4↓+2H2O |
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
(1)aTiO2+bCl2+cC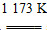 aTiCl4+cCO
aTiCl4+cCO
(2)TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
关于反应(1)、(2)的分析不正确的是
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,发生还原反应 ③每生成19.2 g Ti,反应(1)、(2)中共转移4.8 mol e- ④a=1,b=c=2
A.①②④ B.②③④C.③④D.②③
根据表中信息,判断下列叙述中正确的是( )
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
Fe3+、Br2 |
|
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
下列说法正确的是( )
| A.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA |
| B.化合反应均为氧化还原反应 |
| C.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
| D.易燃试剂与强氧化性试剂分开放置并远离火源 |