25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是( )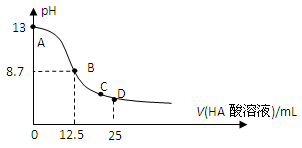
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)
下列反应不属于取代反应的是()
既可以用来鉴别乙烯和甲烷,又可以用来除去甲烷中混有的乙烯的方法是
| A.通入足量溴水中 | B.与足量的溴反应 |
| C.通入酸性KMnO4溶液 | D.在催化剂存在的条件下与H2反应 |
下列说法正确的是
| A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
下列物质中,只含有非极性共价键的是()
| A.Na2O | B.H2O | C.Cl2 | D.NH3 |
在元素周期表中,分别与周期数、主族序数相同的一组是()
①质子数 ②核电荷数 ③电子层数 ④原子序数 ⑤最外层电子数
| A.③⑤ | B.②③ | C.③④ | D.①⑤ |