将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于容器中,加入足量的水,搅拌,静置,过滤。取滤液,用铂电极电解一段时间,则两极区析出的氧化产物和还原产物的质量比为( )
| A.35.5︰108 | B.108︰71 | C.8︰1 | D.1︰2 |
下列结论正确的是
①微粒半径:S2->Cl>S>F②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4⑥非金属性:F>Cl>S
| A.②④⑥ | B.①③④ | C.只有① | D.只有⑥ |
阴离子Xn-含中子N个,X的质量数为A,则a g X的氢化物中含质子的物质的量是
A. mol mol |
B.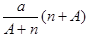 mol mol |
C.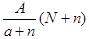 mol mol |
D.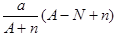 mol mol |
A、B、C、D、E是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中原子半径最大的,则它们的原子序数由小到大的顺序是
A.E、C、D、B、A B.D、B、C、A、E
C.E、B、A、D、C D.A、B、C、D、E
已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1 kJ/mol; 2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 kJ/mol;H2O(g)=H2O(l) ΔH=-Q3 kJ/mol 常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
| A.4Q1+0.5Q2+ Q3 | B.4Q1+Q2+Q3 |
| C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
已知元素As原子序数为33,下列叙述正确的是
| A.As的最高正价为+3价 |
| B.AsH3的稳定性比PH3强 |
| C.氧化物的水化物酸性:As<N |
| D.As是第4周期第VA族元素 |