(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。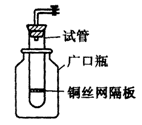
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。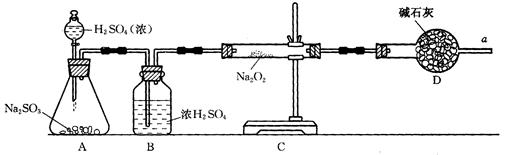
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
| A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧. |
| B.将C装置中反应后的固体物质溶于适量水配成溶液. |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成. |
| D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
(18分)过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。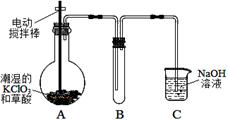
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有;B也必须添加温度控制装置,应该是装置。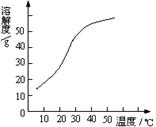
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 = Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是。
②原ClO2溶液的浓度为g / L(用含字母的代数式表示)。
某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题: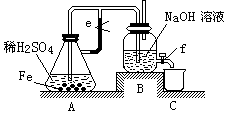
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:,
B中可以观察到的现象是。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是,
有关反应的化学方程式是。
(10分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。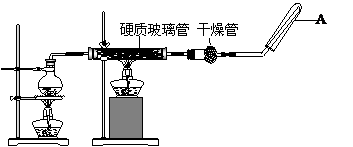
(1)写出该反应的反应方程式;
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是。
(3)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
(8分) )为了证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验。下图为实验所提供的仪器和药品,据此回答下列问题:
⑴各仪器装置连接的顺序为(填接口序号)接、接、
接、接。
⑵装置Ⅰ中的现象是,发生反应的离子方程式为;
⑶仪器Ⅱ中分别加入的试剂为和。(按气体流向先后顺序填)