(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式_____________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式 。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+1/2O2(g)===H2O(l ) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式 。
由铁矿石生产金属铁有两种可能的途径:
①Fe2O3(s)+3∕2C(s)="=2Fe(s)+" 3∕2CO2(g)
△H=231.93kJ·mol-1△S=276.32J·mol-1·K-1
②Fe2O3(s)+3H2(g)==2Fe(s)+3H2O(g)
△H=96.71kJ·mol-1△S=138.79J·mol-1·K-1
(1)试判断这两个反应在高温还是低温下自发进行。
(2)上述反应中的(填序号)可以在较低温度下进行。
已知反应N2O4(g)==2NO2(g)△H=57.24kJ·mol-1△S=176J·mol-1·K-1则在298.15K时该反应自发向进行(填“左”或“右”),在500K时反应自发向进行。
12分)判断下列过程的熵变的正负(填“>0”或“<0”)
(1) 溶解少量蔗糖于水中, △S__________;
(2) 纯碳和氧气反应生成 CO(g), △S__________;
(3) 液态水蒸发变成水蒸气, △S____________;
(4) CaCO3(s)加热分解生成CaO(s)和CO2(g),△S____________。
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。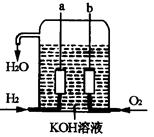
(1)a极是极,b极是极,电极
反应式分别为,。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率。 [2H2(g)+O2(g) 2H2O(l)+572kJ]
[2H2(g)+O2(g) 2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下的H2多少升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式:。此时电池内总的反应方程式为。
下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g)△H1=" a" kJ·mol-1
FeO(s)+CO(g)△H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g)△H2=" b" kJ·mol-1
2CO2(g)△H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s)△H3
2FeO(s)△H3
(1)则△H3=(用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有(填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为。
。则在电解法合成氨的过程中,应将H2不断地通入极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。