已知空气—锌电池的电极反应如下,据此判断,锌片是( )
锌片:Zn+2OH――2e-=ZnO+H2O; 碳棒:O2+2H2O+4e-=4OH-,
| A.正极,被还原 | B.正极,被氧化 |
| C.负极,被还原 | D.负极,被氧化 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:
①Sn(白,s)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(灰,s)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
③Sn(灰,s) 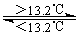 Sn(白,s)ΔH3=+2.1 kJ·mol-1
Sn(白,s)ΔH3=+2.1 kJ·mol-1
下列说法正确的是
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
| A.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
| D.若Y的最高正价为+m,则X的最高正价一定为+m |