有A、B、C、D、E五种短周期元素, 它们的原子序数依次增大。已知A和B原子具有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍, C是该周期中原子半径最大的元素, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。试根据以上叙述回答:
 (1)元素名称: A C __________ E
(1)元素名称: A C __________ E 
 (2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;
(2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ; 写出 C2B2与AB2反应的化学方程式
写出 C2B2与AB2反应的化学方程式
 ;
; 
 (3)画出D的原子结构示意图 ,
(3)画出D的原子结构示意图 ,
 用电子式表示化合物 C2D 的形成过程 ;
用电子式表示化合物 C2D 的形成过程 ; (4)D、E的气态氢化物的稳定性 大于 (填化学式)。
(4)D、E的气态氢化物的稳定性 大于 (填化学式)。
书写下列化学反应方程式
(1)NO2与水反应
(2)C与浓硫酸反应
(3)Mg与CO2反应
书写下列离子反应方程式
(1)氯化铝与过量的氢氧化钠溶液反应
(2)NaAlO2溶液与足量的盐酸反应
(3)NaAlO2中通入过量的CO2气体
(4)FeCl3+H2S
(5)过量的Zn加入到FeCl3溶液中
(6)FeSO4+O2(酸性条件下)
(7)明矾净水
(14分) E是一种香料,可用下图的设计方案合成。
已知:A是一种饱和一氯代烃。
(1)A的结构简式为:。
(2)完成下列化学反应方程式为:
B→C:
B+D→E:
(3)F→G的化学反应类型是。
(4)写出检验C中官能团的化学反应方程式:。
(5)E有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是:
。(用结构简式表示)
(6分)有化合物: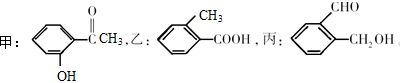
(1)请写出丙中含氧官能团的名称:______________。
(2)请判别上述哪些化合物互为同分异构体:_______ ___________________________。
___________________________。
(3)请按酸性由强到弱排列甲、乙、丙的顺序 。
。
(10分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________,名称为___________________________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。
(3)已知A、B、C有如下转化关系:
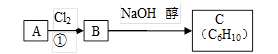
则反应②的化学方程式为;
反应的类型是